遺伝子治療関連
白質ジストロフィーを対象とした遺伝子治療総括
Jonquieres et al.(2021): Emerging Concepts in Vector Development for Glial Gene Therapy: Implications for Leukodystrophies; Front. Cell. Neurosci., 22 June 2021 ; doi: 10.3389/fncel.2021.661857 [PMC]
これまで行われた白質ジストロフィーを対象とした遺伝子治療に関するレビュー論文。AAVベクターによる遺伝子導入が話題の中心ではあるが,その他の手法(造血幹細胞移植など)についても網羅的にレビューされている。
遺伝子治療の種類
・造血幹細胞移植(hematopoietic stem cell transplantation; HSCT)
骨髄中に存在し,様々な細胞へ分化する能力を持った造血幹細胞を移植する治療方法。患者に対し,健常人ドナーから採取した造血幹細胞を移植(他家移植)することで,正常な細胞に置換する。よく耳にする骨髄移植とほぼ同義であるが,厳密には,造血幹細胞は,末梢血や臍帯血など、骨髄以外にも入手方法が多様化しているので、造血幹細胞移植のひとつとして骨髄移植があるという位置づけである。
他家移植による造血幹細胞移植は,遺伝子治療のはしりとなる技術で,白質ジストロフィーでは,X連鎖副腎白質ジストロフィー(ALD)、異染性白質ジストロフィー(MLD)、クラッベ病などに対する実績がある(Musolino et al.,2014 ; Page et al.,2019)。課題として,提供元のドナーと患者とのHLA(白血球の型)が適合していない場合には,免疫不全による重度の感染症などを起こすリスクが高まる。なかなかHLAが完全に適合するドナーを探すのは難しいのが現状のようで,部分的に適合したドナーからの移植により,移植後に弊害が生じたケースも多く報告されている。
・自家移植による造血幹細胞移植(HSC-GT)
上記の他家移植におけるリスクを踏まえた代替法であり,患者自身の造血幹細胞を採取・培養し、遺伝子変異を体外で修正し再注入する手法。実績は多くないが,本人の細胞なので,HLA不適合による免疫不全などのリスクは少ないメリットがある。ALD,MLDなどで実績がある。
・その他の細胞ベースの治療法
患者由来のiPSCを遺伝子修正して患者に戻す手法(Feng et al.,2020)や,グリア前駆細胞(glial-restricted precursors;hGRP)移植(PMDの例:Uchida et al.,2000,Cummings et al.,2005, Uchida et al.,2012,Gupta et al.,2012, Gupta et al.,2019,低髄鞘化マウスの例:Windrem et al.,2008,Windrem et al.,2014,Stanaszek et al.,2021,VWMの例:Dooves et al.,2019,クラッベ病-ES細胞より分化したグリア前駆細胞移植の例:Kuai et al.,2015)など新たな細胞ベースの治療法も開発されている。
・in vivo遺伝子治療(治療用核酸をウィルスベクターにより送達する手法)
ベクター(遺伝子の運び屋)を用いて,体内に正常な遺伝子を導入する手法。これまで,アデノウィルス,レンチウィルス(LV),レトロウィルス(RV)など様々なウィルスベクターが検討されてきたが,近年では,アデノ随伴ベクター(AAV)が主流となっている。AAVは,他のベクターと比較して,安全性,形質導入効率、汎用性,生産しやすさなどが優れているらしい。
グリア細胞の遺伝子変異に起因する疾患に対する治療アプローチの検討も数多くあり,標的となる細胞へより効率的に遺伝子送達するために,AAV自体も進化している。また,プロモーターと呼ばれる情報をベクターに乗せることで,特定の細胞で特異的に発現されるようにする技術も開発されている。
・ASO(アンチセンスオリゴヌクレオチド)遺伝子治療
(勉強中)
・白質ジストロフィーの遺伝子治療研究事例
論文で紹介された遺伝子治療研究事例を下表に示す。一部,論文で紹介されていないが管理人が見つけた事例も追記している(今後も重要そうな事例を見つけたら適宜追記する)。
<疾患凡例>
PMD:ペリツェウス・メルツバッハー病(PLP1遺伝子変異)
PMLD:ペリツェウス・メルツバッハー様疾患(GJC2遺伝子変異)
CD:カナバン病(ASPA遺伝子変異)
MLD:異染性白質ジストロフィー(ARSA遺伝子変異)
GLD:球形細胞白質ジストロフィー(クラッベ病;GALC遺伝子変異)
AxD:アレキサンダー病(GFAP遺伝子変異)
VWM:白質消失病(EIB-5F遺伝子変異)
ALD:副腎白質ジストロフィー(ABCD1遺伝子変異)
白質ジストロフィーの遺伝子治療研究事例
| 疾患 | 手法 | 出典・内容 |
|---|---|---|
| PMD | グリア前駆細胞移植 | Cummings et al.(2005), Uchida et al.(2012)などでマウスによる前臨床研究が行われ,2009年に臨床試験(NCT01005004)が開始,Gupta et al.(2012),Gupta et al.(2019)などで結果に関する報告が行われている。移植された宿主の白質におけるドナー由来ミエリンの生着および限局性産生を示したが、患者の半数で免疫応答およびドナー特異的HLA同種抗体を検出した。 |
| invivo遺伝子導入(AAV) | Li et al.(2019)。国立神経精神医学センターの井上健先生らのグループによる研究。 | |
| グリア前駆細胞移植 | Windrem et al.(2008),Stanaszek et al.(2021)など。 | |
| ASO | Elitt et al.(2021)。マウスに対するASO治療。 | |
| PMLD | invivo遺伝子導入(AAV) | Georgiou et al.(2017) |
| CD | invivo遺伝子導入(AAV) | McPhee et al.(2005)。rAAV2による遺伝子送達。疾患の表現型を効果的に救済することはできず。 |
| Ahmed et al.(2013)。hASPAを遍在的に発現するrAAV9の単回静脈内注射。KOマウスの重度の神経表現型の部分的救済を達成。 | ||
| Gessler et al.(2017)。アストロサイトを標的とした治療。オリゴデンドロサイトの直接治療は治療の成功に必要ではなく、アストロサイトがN-アセチルアスパラギン酸(ASPAタンパクが分解すべき物質)代謝において重要な役割を果たすことを示している。 | ||
| Jonquieres et al.(2018)。 | ||
| Francis et al.(2016),Francis et al.(2021)。2021年に臨床試験(NCT04833907)が開始。 | ||
| 患者由来iPSC移植 | Feng et al.,2020。患者由来iPSCをex vivoで遺伝子修正し,患者に再導入する治療法。HSC-GTのiPSCバージョンというイメージ。この研究では,前臨床的検討として,CDに罹患したマウスに注入し,症状の改善を確認している。研究グループはアレキサンダー病のiPSCによる病態解明を行っていたベックマン研究所のグループ。1疾患に拘らずプラットフォーム技術の開発に注力している印象。 | |
| MLD | HSCT | Boucher etal .,2015 |
| HSC-GT | Biffi et al.(2006),Biffi et al.(2008),Biffi et al.(2013)など。2010年臨床試験(NCT01560182)が開始。Sessa et al.,2016,Fumagalli et al.(2022)などで上記臨床試験結果の報告が行われ,ヨーロッパでLibmeldyという医薬品が承認された。Libmeldyの有効性は,MLDの若年性後期変異体を対象とした臨床試験(NCT04283227)でさらに研究されている。 | |
| invivo遺伝子導入(AAV) | マウス前臨床研究:Sevin et al.(2006),Sevin et al.(2007),Piguet et al.(2012),霊長類前臨床研究:Colle et al(2010),Rosenberg et al.(2014),Zerah et al(2015)。2014年臨床試験(NCT01801709)が開始。脳内のARSA活性の長期的な回復にもかかわらず,治療による予防及び安定化は達成できず(Sevin et al.,2021)。 | |
| invivo遺伝子導入(LV) | 深セン免疫研究所(中国)。レンチウィルスベクターによる遺伝子送達。2018年に臨床試験(NCT03725670)が開始。論文は無い。 | |
| GLD | HSCT | Escolar et al.(2005)。1998年8月から2004年8月の間に造血間細胞移植を受けた患者の報告 |
| Wright et al.(2017)。2000年1月から2011年9月に造血幹細胞移植を受けた患者の報告。 | ||
| invivo遺伝子導入(AAV) | Marshall et al.(2018) | |
| Pan et al.(2019) | ||
| イヌ前臨床研究(クラッベ病は犬の遺伝性疾患でもあり,自然発生的に罹患した犬が存在した模様):Bradbury et al.(2018), Bradbury et al.(2020)。2021年に臨床試験(NCT04693598)が開始。 | ||
| Karumuthil-Melethil et al.(2016)。AAV9、AAVrh10、AAV-Olig001のベクター比較(マウス対象)。 | ||
| HSCT+invivo遺伝子導入(AAV) | Rafi et al.(2020)。造血幹細胞移植とAAVによる遺伝子導入を組み合わせた手法。 | |
| HSC-GT | Ungari et al.(2015)。レンチウィルスベクターの最適化に関する研究。 | |
| AxD | ASO | Hagemann et al.(2018),Hagemann et al.(2021)(国立神経精神医学センターの井上健先生のレビュー)。2021年に臨床試験(NCT04849741)が開始。 |
| MLC | invivo遺伝子導入(AAV) | Sanchez et al.(2020)。下で別途レビューしている。 |
| VWM | グリア前駆細胞移植 | Dooves et al.(2019)。下で別途レビューしている。 |
| ALD | HSCT | Matsukawa et al.(2020)。成人発症型ALD |
| HSC-GT | Cartier et al.(2009)。CD34+造血幹細胞を体外で遺伝子修正し,再注入する自家移植。適合ドナーがいない2人のALD患者で実施され,いずれも細胞の注入後14?16か月で、進行性脳脱髄が停止したと報告されている。 | |
| HSC-GT | Eichler et al.(2017)。2013年10月~2015年7月に行われた4歳~13歳までの合計17人の患者に対する臨床試験(NCT01896102)の報告。治療後12~18か月経過後に効果が出てくるとのこと。これは,元のミクログリアが細胞死→移植細胞に置換のプロセスがそれくらいの期間と示唆されている。この研究の最新の報告(Kuhl et al.,2020)によると、登録された32人の患者のうち31人で疾患の進行が安定し、15人の患者全員が2年間で主要な機能障害が無かったとのこと。 |
| 疾患 | 手法 | 出典・内容 |
|---|---|---|
| PMD | グリア前駆細胞移植 | Cummings et al.(2005), Uchida et al.(2012)などでマウスによる前臨床研究が行われ,2009年に臨床試験(NCT01005004)が開始,Gupta et al.(2012),Gupta et al.(2019)などで結果に関する報告が行われている。移植された宿主の白質におけるドナー由来ミエリンの生着および限局性産生を示したが、患者の半数で免疫応答およびドナー特異的HLA同種抗体を検出した。 |
| invivo遺伝子導入(AAV) | Li et al.(2019)。国立神経精神医学センターの井上健先生らのグループによる研究。 | |
| グリア前駆細胞移植 | Windrem et al.(2008),Stanaszek et al.(2021)など。 | |
| ASO | Elitt et al.(2021)。マウスに対するASO治療。 | |
| PMLD | invivo遺伝子導入(AAV) | Georgiou et al.(2017) |
| CD | invivo遺伝子導入(AAV) | McPhee et al.(2005)。rAAV2による遺伝子送達。疾患の表現型を効果的に救済することはできず。 |
| Ahmed et al.(2013)。hASPAを遍在的に発現するrAAV9の単回静脈内注射。KOマウスの重度の神経表現型の部分的救済を達成。 | ||
| Gessler et al.(2017)。アストロサイトを標的とした治療。オリゴデンドロサイトの直接治療は治療の成功に必要ではなく、アストロサイトがN-アセチルアスパラギン酸(ASPAタンパクが分解すべき物質)代謝において重要な役割を果たすことを示している。 | ||
| Jonquieres et al.(2018)。 | ||
| Francis et al.(2016),Francis et al.(2021)。2021年に臨床試験(NCT04833907)が開始。 | ||
| 患者由来iPSC移植 | Feng et al.,2020。患者由来iPSCをex vivoで遺伝子修正し,患者に再導入する治療法。HSC-GTのiPSCバージョンというイメージ。この研究では,前臨床的検討として,CDに罹患したマウスに注入し,症状の改善を確認している。研究グループはアレキサンダー病のiPSCによる病態解明を行っていたベックマン研究所のグループ。1疾患に拘らずプラットフォーム技術の開発に注力している印象。 | |
| MLD | HSCT | Boucher etal .,2015 |
| HSC-GT | Biffi et al.(2006),Biffi et al.(2008),Biffi et al.(2013)など。2010年臨床試験(NCT01560182)が開始。Sessa et al.,2016,Fumagalli et al.(2022)などで上記臨床試験結果の報告が行われ,ヨーロッパでLibmeldyという医薬品が承認された。Libmeldyの有効性は,MLDの若年性後期変異体を対象とした臨床試験(NCT04283227)でさらに研究されている。 | |
| invivo遺伝子導入(AAV) | マウス前臨床研究:Sevin et al.(2006),Sevin et al.(2007),Piguet et al.(2012),霊長類前臨床研究:Colle et al(2010),Rosenberg et al.(2014),Zerah et al(2015)。2014年臨床試験(NCT01801709)が開始。脳内のARSA活性の長期的な回復にもかかわらず,治療による予防及び安定化は達成できず(Sevin et al.,2021)。 | |
| invivo遺伝子導入(LV) | 深セン免疫研究所(中国)。レンチウィルスベクターによる遺伝子送達。2018年に臨床試験(NCT03725670)が開始。論文は無い。 | |
| GLD | HSCT | Escolar et al.(2005)。1998年8月から2004年8月の間に造血間細胞移植を受けた患者の報告 |
| Wright et al.(2017)。2000年1月から2011年9月に造血幹細胞移植を受けた患者の報告。 | ||
| invivo遺伝子導入(AAV) | Marshall et al.(2018) | |
| Pan et al.(2019) | ||
| イヌ前臨床研究(クラッベ病は犬の遺伝性疾患でもあり,自然発生的に罹患した犬が存在した模様):Bradbury et al.(2018), Bradbury et al.(2020)。2021年に臨床試験(NCT04693598)が開始。 | ||
| Karumuthil-Melethil et al.(2016)。AAV9、AAVrh10、AAV-Olig001のベクター比較(マウス対象)。 | ||
| HSCT+invivo遺伝子導入(AAV) | Rafi et al.(2020)。造血幹細胞移植とAAVによる遺伝子導入を組み合わせた手法。 | |
| HSC-GT | Ungari et al.(2015)。レンチウィルスベクターの最適化に関する研究。 | |
| AxD | ASO | Hagemann et al.(2018),Hagemann et al.(2021)(国立神経精神医学センターの井上健先生のレビュー)。2021年に臨床試験(NCT04849741)が開始。 |
| MLC | invivo遺伝子導入(AAV) | Sanchez et al.(2020)。下で別途レビューしている。 |
| VWM | グリア前駆細胞移植 | Dooves et al.(2019)。下で別途レビューしている。 |
| ALD | HSCT | Matsukawa et al.(2020)。成人発症型ALD |
| HSC-GT | Cartier et al.(2009)。CD34+造血幹細胞を体外で遺伝子修正し,再注入する自家移植。適合ドナーがいない2人のALD患者で実施され,いずれも細胞の注入後14?16か月で、進行性脳脱髄が停止したと報告されている。 | |
| HSC-GT | Eichler et al.(2017)。2013年10月~2015年7月に行われた4歳~13歳までの合計17人の患者に対する臨床試験(NCT01896102)の報告。治療後12~18か月経過後に効果が出てくるとのこと。これは,元のミクログリアが細胞死→移植細胞に置換のプロセスがそれくらいの期間と示唆されている。この研究の最新の報告(Kuhl et al.,2020)によると、登録された32人の患者のうち31人で疾患の進行が安定し、15人の患者全員が2年間で主要な機能障害が無かったとのこと。 |
白質ジストロフィーでは,PMD,カナバン病,クラッベ病,MLD,ALDあたりが遺伝子治療の研究が進んでいる印象。MLCは,Sánchez et al.(2020)よる前臨床研究でAAV遺伝子治療の効果が示されているので,AAV遺伝子治療で先行しているカナバン病,クラッベ病,MLDの研究が参考になるかもしれない。一方で,アストロサイト疾患においてはアレキサンダー病,VWMともにAAV遺伝子治療の研究は行われていないので,アストロサイトを標的とした効果的な遺伝子送達のノウハウについては,まだ知見が少ないと思われる。
MLC1のAAVによる遺伝子治療
Sanchez et al.(2020): Cerebellar Astrocyte Transduction as Gene Therapy for Megalencephalic Leukoencephalopathy; Neurotherapeutics . 2020 Oct;17(4):2041-2053; doi : 10.1007/s13311-020-00865-y [PMC]
バルセロナ大学の研究グループによる,MLCのメカニズムと,遺伝子治療に関する研究。アデノ随伴ウイルス(AAV)を媒体として,MLC1遺伝子を人為的に変異させたマウスに正常なMLC1遺伝子を導入することで,発症からほぼ1年後の15か月齢(人間に換算して約37歳)のマウスにおいても,無症状のマウスと同様のレベルに回復したことが示されている。このことから,顕著な神経変性はなく臨床表現型は可逆的である可能性があること,また,広い治療域がありどの年齢でも治療できる可能性があることが示唆されている。ただし,自閉症や認知機能低下などの他の表現型は、非常に早い段階での発達過程の変化の結果であり,修正がより難しい可能性があることも示されている。
人間への治療へ展開するための今後の課題として,
・小脳でのみMLCを発現させるだけでこれらの症状を改善できるかどうかの確認
・ヒト以外の霊長類、犬、豚などの大型動物を対象とした検証
などが挙げられている。
話は少しそれるが,この論文中で,ペリツェウス・メルツバッハー様疾患(Cx47;GJC2),カナバン病のマウスに対する AAV を用いた遺伝子治療において有意な表現型の改善をもたらした事例 (Georgiou et al., 2017 ; Gessler et al., 2017) が参照されており,MLC同様に臨床表現型が可逆的である可能性が示唆されている。
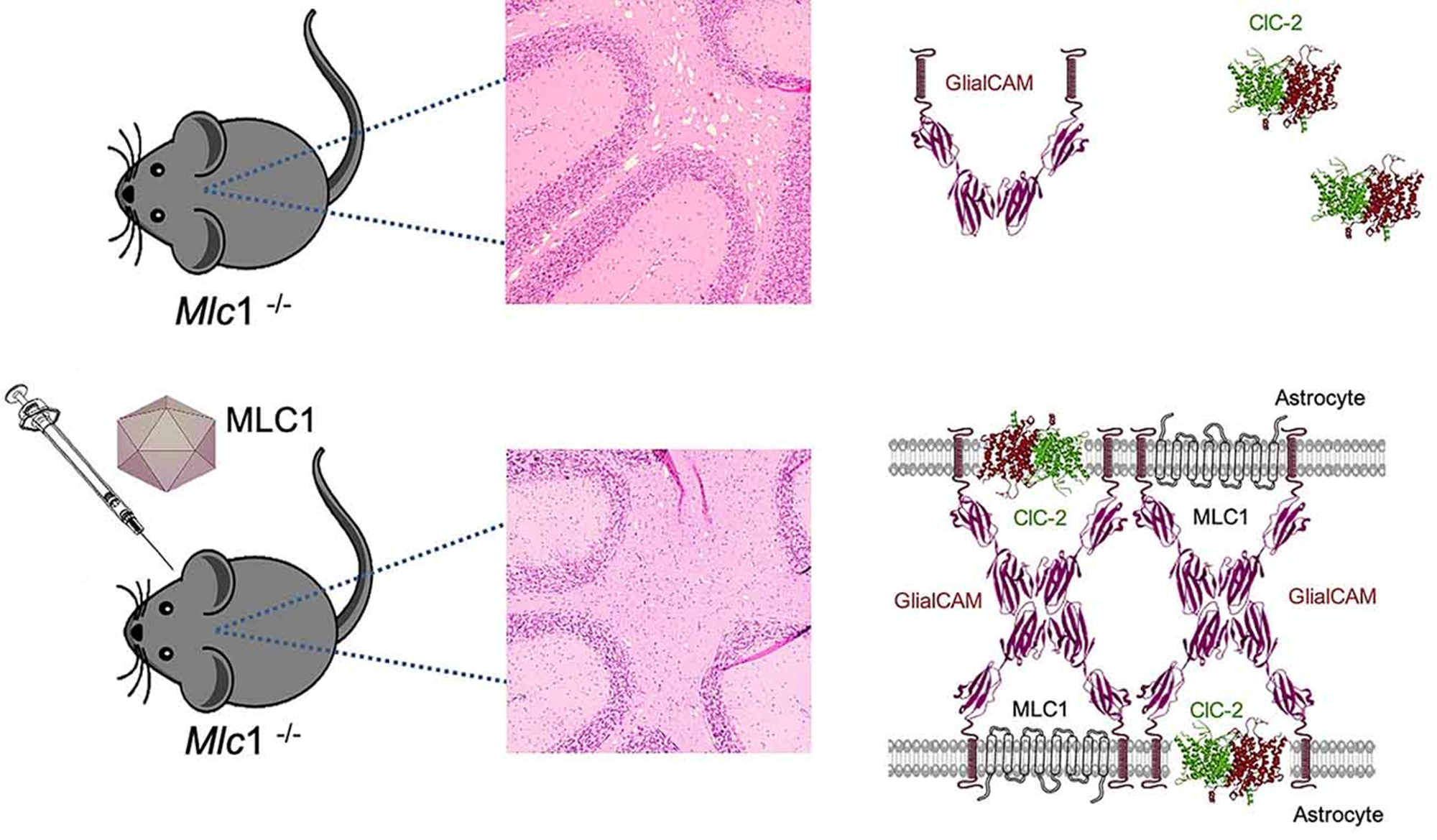
遺伝子治療のイメージ(論文より転載)
白質消失病のグリア前駆細胞移植による遺伝子治療
Dooves et al.(2019): Cell Replacement Therapy Improves Pathological Hallmarks in a Mouse Model of Leukodystrophy Vanishing White Matter; Stem Cell Reports Volume 12, Issue 3, 5 March 2019, Pages 441-450; doi : 10.1016/j.stemcr.2019.01.018
VU大学の研究グループによる,同じアストロサイト疾患である白質消失病(VWM)に対する,グリア前駆細胞移植による遺伝子治療アプローチに関する研究。マウスに対し上記治療を行った結果,症状が改善した例が示されている。
この治療法は,ペリツェウス・メルツバッハー病(PMD)の患者(ヒト)に対する臨床試験において有効性が既に確認されており,白質ジストロフィー全般に有効である可能性が示唆されている。
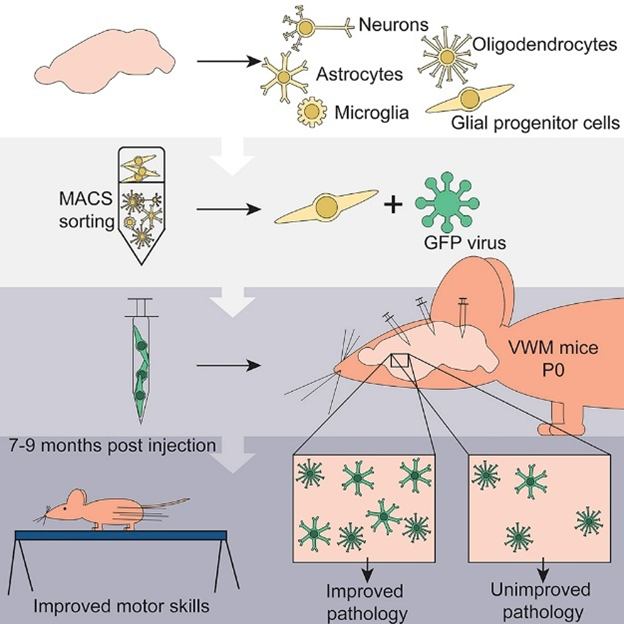
マウスを対象としたグリア細胞移植治療のイメージ(論文より転載)
VWMで遺伝子治療を試みた初めての研究。遺伝子治療ではAAVベクターによる遺伝子導入の方が最近は主流と思われるが,VWMではAAVに関する研究はまだ行われていない。その要因としては,VWMの変異遺伝子であるeIF2Bは,アストロサイトだけでなく,オリゴデンドロサイト,ミクログリアなど複数の細胞にわたって発現されるため,複数細胞をターゲットとした遺伝子導入はAAVでは難しいことが考えられる。神経細胞に分化する前の神経前駆細胞を導入するアプローチの方が,VWMに対しては相性がいいのかもしれない。MLCにおける遺伝子治療検討例は今のところAAVベクターの遺伝子導入アプローチだけだが,グリア前駆細胞移植も有望なアプローチとなる可能性はある。


