MLC病態解明
新しい変異遺伝子AQP4,GPRC5Bの発見(VU大学)
Passchier et al.(2023): Aquaporin-4 and GPRC5B: old and new players in controlling brain oedema; Brain. Aug 1;146(8):3444-3454. doi: 10.1093/brain/awad146.
VU大学の研究グループによる論文。臨床的特徴とMRIによってMLCと診断された患者のうち,MLC1またはGLIALCAM変異も持たない患者に対して新規遺伝子変異体を特定するために遺伝子研究を実施し,新たにAQP4,GPRC5Bという遺伝子が発見されたことが報告されている。
MLCの病態と治療に関するこれまでの研究総括(バルセロナ大学)
Bosch et al.(2021): Megalencephalic Leukoencephalopathy: Insights Into Pathophysiology and Perspectives for Therapy; Front. Cell. Neurosci., 22 January 2021; doi : 10.3389/fncel.2020.627887
バルセロナ大の研究グループによるレビュー論文。これまで行われてきたMLCのほとんどの研究がレビューされているので,2021年時点での病態解明の現状が概ね把握できる。
MLCと関連の深いタンパクとして,MLC1,GlialCAM,ClC-2,Na+/K+ATPアーゼ,そのほかのATPアーゼ(PMCA1,2,3,SERCA1,2,V-ATPアーゼ),VRAC チャネル(LRRC8A),Cx43,TRPV4,Kir4.1,AQP4などが挙げられている。
これまで20年近くの研究で,MLC病態に関する知見はかなり蓄積されているように思われるが,バルセロナ大学は,まだまだMLCについて未知のメカニズムが多く残っているため,MLC1/GlialCAMを直接修正する遺伝子治療のアプローチが最も現実的と考えている印象。
アストロサイト疾患におけるグリア細胞の相互作用(オランダVU大学)
deWaard et al.(2020): Astrocyte–Oligodendrocyte–Microglia Crosstalk in Astrocytopathies, Front. Cell. Neurosci., 19 November 2020; doi ; 10.3389/fncel.2020.608073 [PMC]
VU大学による報告。van der knaapは共著者に入っていないが,同じVU大学UMCに所属している研究者による報告である。「アストロサイト疾患」として分類される「白質消失病(VWM)」、「アレキサンダー病(AxD)」、「MLC」、「ClC-2関連疾患」、「エカルディ・グティエール症候群(AGS)」,「眼球歯状突起異形成症(ODDD)」に関する最新の知見を,既往研究のレビューによりまとめている。
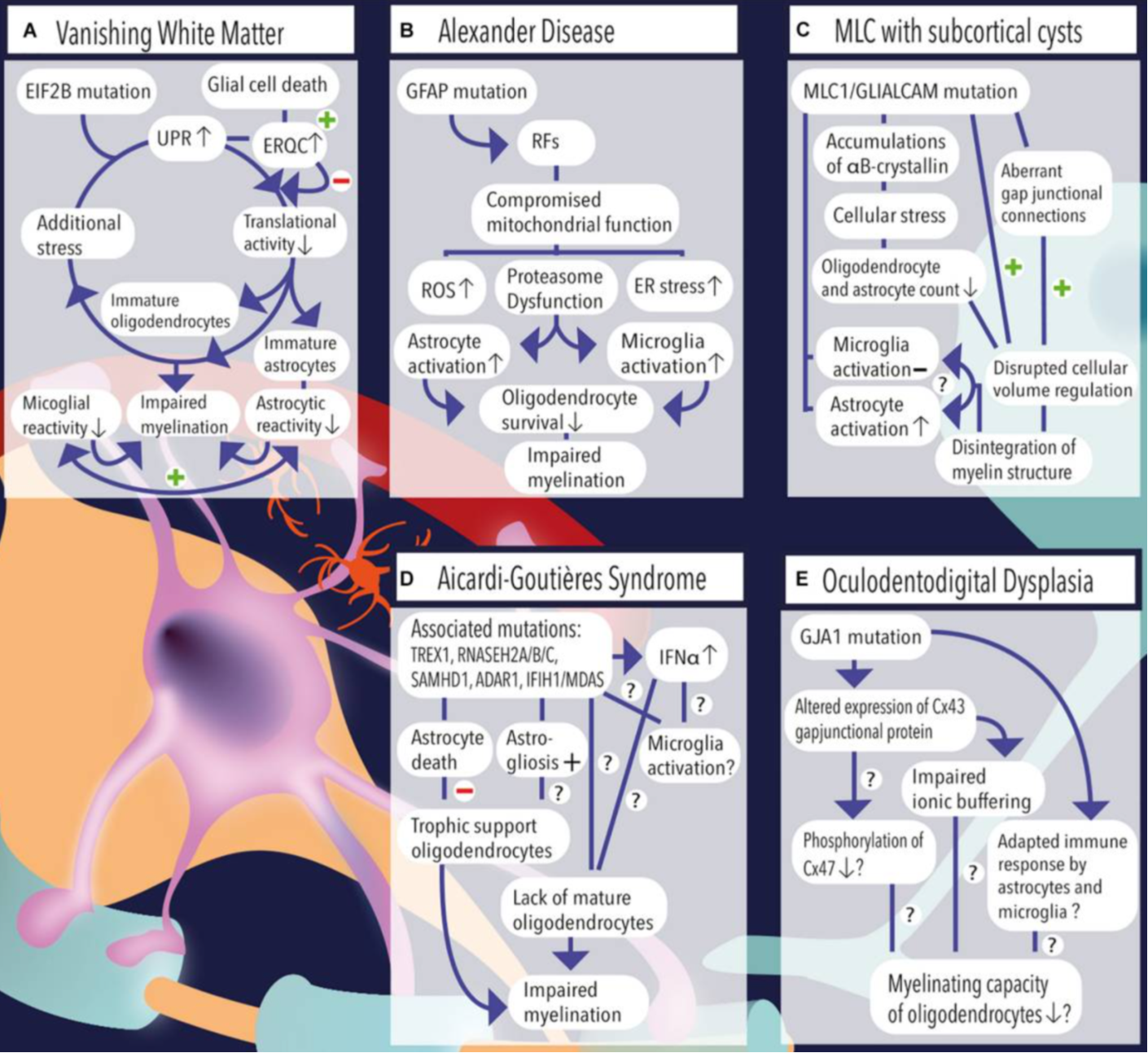
それぞれのアストロサイト疾患のメカニズム(論文より転載)
それぞれのアストロサイト疾患の概要
| 疾患 | グリア細胞 | 病態 | ハイライト |
|---|---|---|---|
| 白質消失病 | ■アストロサイト ・皮質下U線維の星状細胞数の減少 ・未成熟で非活性化された表現型:幅広い鈍いプロセス ・アストログリオーシスは見られない ■オリゴデンドロサイト ・OPC(オリゴデンドロサイト前駆細胞)に対する成熟オリゴデンドロサイト比の増加 ■ミクログリア ・ミクログリオーシスは見られない |
・ミエリンの菲薄化,欠如,空胞化、組織の希薄化とキャビテーション ・グリアUPR(小胞体ストレス応答)の活性化の上昇 ・細胞骨格の欠陥 |
・ミトコンドリア機能の欠陥(酸化的リン酸化の低下) ・ECM分子(ヒアルロン酸)の組成の変化 ・アストロサイトとミクログリアの炎症反応の低下 ・オリゴデンドロサイト成熟欠陥 |
| アレキサンダー病 | ■アストロサイト ・アストロサイト数は変化なし ・活性化された表現型と細胞質基質におけるローゼンタール線維の存在 ・アストログリオーシス++ ■オリゴデンドロサイト ・OPCの成熟停止 ・成熟度の低いオリゴデンドロサイト ・細胞外環境におけるイオン緩衝の欠陥によるオリゴデンドロサイト生存率の低下 ■ミクログリア ・ミクログリオーシス++ |
・ミエリンの欠如または喪失 ・ミトコンドリア機能の低下 ・細胞の酸化ストレスのレベルの上昇 |
・プロテアソーム機能障害 ・小胞体ストレス→グリア細胞反応性への寄与 ・細胞外環境におけるイオンバランスの制御障害 ・ECM分子(ヒアルロン酸およびCHI3L1)の組成の変化 |
| MLC | ■アストロサイト ・アストロサイトの減少 ・細胞の体積調節の乱れによる膨張 ・アストログリオーシス+ ■オリゴデンドロサイト ・オリゴデンドロサイトの減少 ■ミクログリア ・ミクログリオーシスは見られない |
・大脳白質の空胞化 ・ミエリンの量は変化なし ・イオン-水恒常性の調節不全 |
・ギャップ結合の変化 |
| エカルディ・グディエール症候群 | ■アストロサイト ・アストロサイトの減少 ・アストログリオーシス+ ■オリゴデンドロサイト ・OPCに対する成熟オリゴデンドロサイト比の増加 ・オリゴデンドロサイトアポトーシス(細胞死)率の増加 ■ミクログリア ・ミクログリオーシス± |
・ミエリンの欠如 ・IFNα(インターフェロンα)レベルの増加と制御不全 ・頭蓋内石灰化ならびに小血管壁の石灰化、重度の小頭症、ミエリンの欠如、皮質微小梗塞、組織の炎症 |
|
| 眼球歯状突起異形成 | 不明 | ・Cx43の発現の低下→ギャップ結合の変化 ・アストロサイトとミクログリアによる免疫応答の制御不全 |
筆者が結論で述べていたが,MLCあるいはGlialCAM変異の影響を受けるタンパク質は上述した通りいろいろあるが,その中では,Cx43の障害によるアストロサイト同士のギャップ結合の障害の影響が比較的大きそうな印象。Lanciotti et al(2020)では,Cx43とERK伝達経路との関連が示唆されていたので,ここを標的とした治療アプローチは有効かもしれない。
MLC1がCx43へ与える影響について(イタリアISS)
Lanciotti et al.(2020): Megalencephalic Leukoencephalopathy with Subcortical Cysts Disease-Linked MLC1 Protein Favors Gap-Junction Intercellular Communication by Regulating Connexin 43 Trafficking in Astrocytes; Cells 2020, 9(6), 1425; doi : 10.3390/cells9061425 [PMC]
イタリアISSの研究グループによる報告。正常なMLC1タンパクが,シグナル伝達分子のひとつであるERKを介したCx43のリン酸化を抑え、Cx43ギャップ結合の安定性を高めることによって細胞間のコミュニケーションを促進することを明らかにした研究。
ERKが体積調節チャネル(VRAC)のLRRC8Cサブユニットにも影響を与えること(Elorza-Vidal et al.,2018)や,Cx43ギャップ結合の欠陥がK+イオンの調節不全につながることを示した過去の知見も踏まえ,ERKを標的とした治療法の有効性が示唆されている。
また,Cx43が出生後の血液脳関門 (BBB)成熟プロセスにおいて必要な役割を担う(Gilbert A, et al., 2018)ことから,MLC患者において出生後早期に現れる症状である巨頭症が, MLC1変異によるCx43異常に起因している可能性が示唆されている。
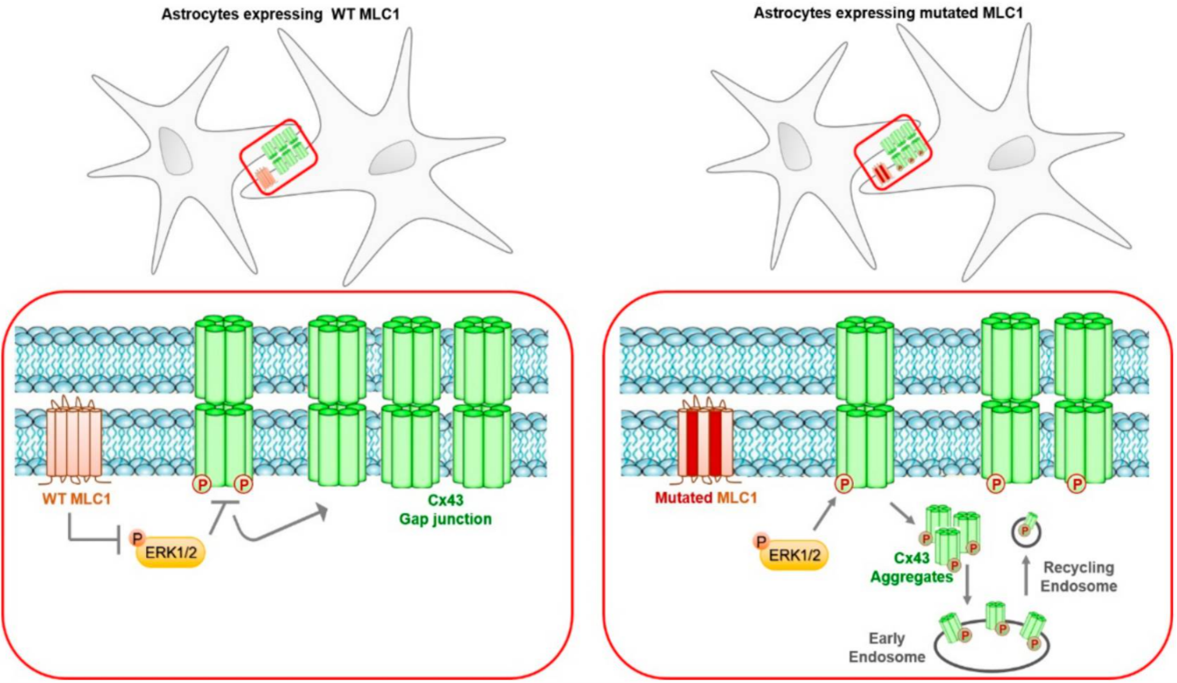
アストロサイトにおけるMLC1を介したCx43調節メカニズムの概略図(論文より転載)
この論文中に,患者由来のiPS細胞から分化した星状細胞を用いた研究が現在進行中であることが示されている。この件について,ISSのホームページに記載があった(2021年8月現在)。このホームページでは,以下のことが示されている。
・MLC1は、特定の細胞内シグナル伝達分子(EGFR、ERK、NF-kB、STAT3)の調節を通じて、イオンおよび水交換に関与する多数のタンパク質(イオンチャネル/ポンプ、水チャネル)の機能に影響を与える。
・MLC1の病理学的変異は、これらのシグナル伝達経路を変化させることにより、異常な腫れ、細胞ストレス、増殖の活性化など、星状細胞で観察される機能障害を引き起こす。
・上記分子は、細胞内シグナル伝達経路の正しい機能を回復するために薬理学的に調整できることを考えると、MLCに有効な治療法を特定できる可能性がある。
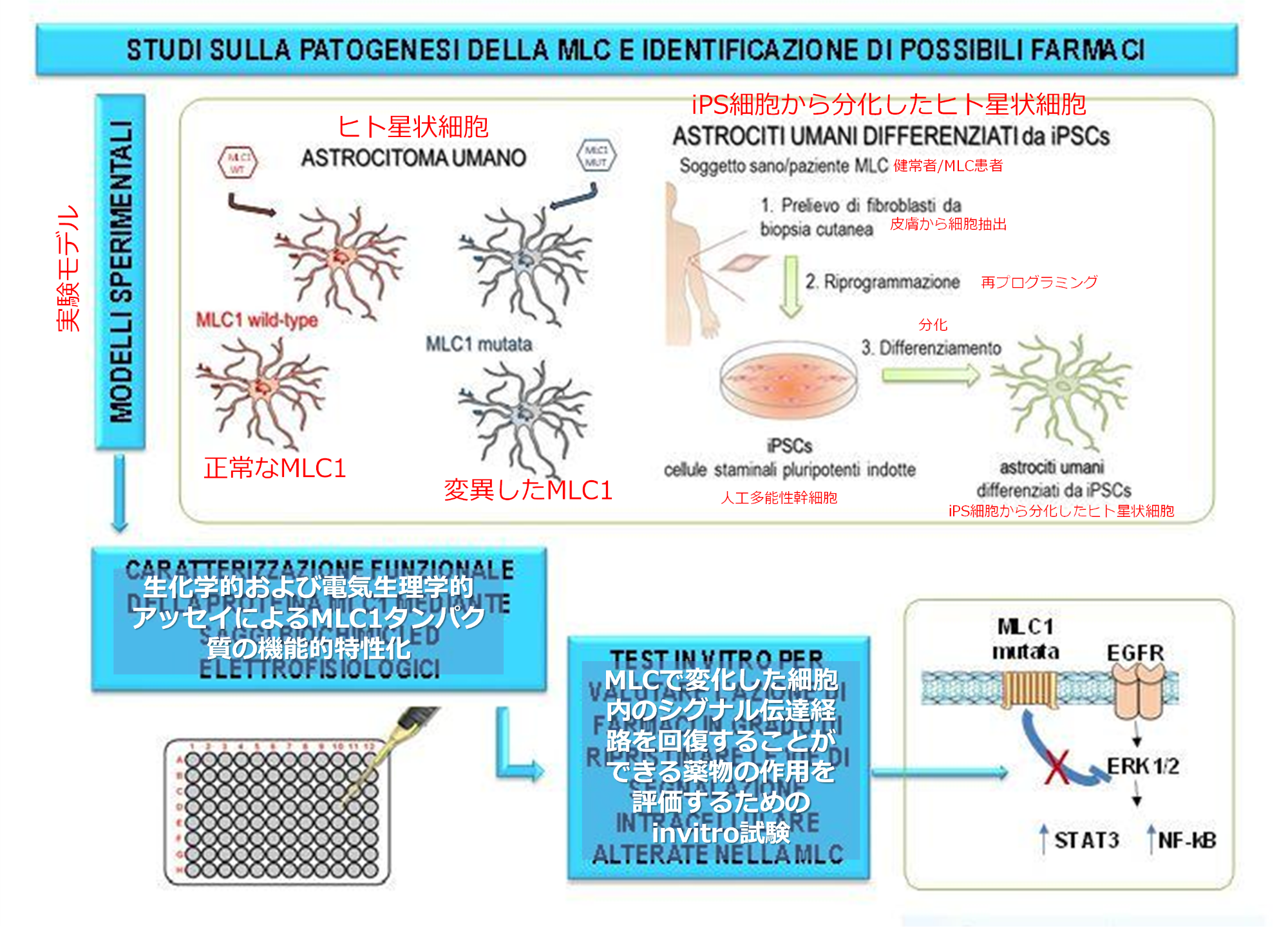
iPS細胞を用いた研究の模式図(ISSのホームページより転載・日本語加筆)
バルセロナ大学が進めている遺伝子治療のように根本的な治療ではないかもしれないが,シグナル伝達経路を標的とした分子標的薬はがんの治療薬として既に承認された薬が多くあるので,遺伝子治療より早く治療法が確立される可能性が期待できる。
GlialCAM/MLC1のVRACチャネルに対する制御(バルセロナ大学とイタリアISS)
Elorza-Vidal et al.(2018): GlialCAM/MLC1 modulates LRRC8/VRAC currents in an indirect manner: Implications for megalencephalic leukoencephalopathy; Neurobiology of Disease Volume 119, November 2018, Pages 88-99; doi : 10.1016/j.nbd.2018.07.031
バルセロナ大学とイタリアISSの共著。MLC1とGlialCAM変異が,シグナル伝達分子のひとつであるERKを介して,体積調節チャネル(VRAC)のLRRC8Cサブユニットに影響を与える可能性があることが示されている。
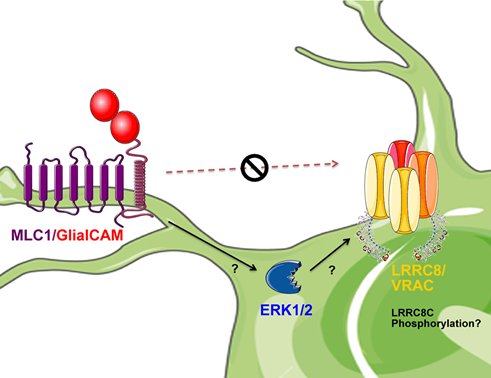
MLC/GlialCAM変異がLRRC8に影響を与えるメカニズムの概略図(論文より転載)
MLC1のEGFRシグナル伝達に対する制御(イタリアISS)
Lanciotti et al.(2016): Megalencephalic leukoencephalopathy with subcortical cysts protein-1 regulates epidermal growth factor receptor signaling in astrocytes; Human Molecular Genetics, Volume 25, Issue 8, 15 April 2016, Pages 1543–1558; doi : 10.1093/hmg/ddw032
イタリアISSの研究グループによる,MLC1変異が,シグナル伝達分子のひとつである上皮成長因子受容体(EGFR)の働きに影響を与えることを明らかにした研究。EGFRはアストロサイトなどの細胞を増殖する働きがあり,MLC1はその過剰な活性化を抑える機能がある。MLC1変異はその制御機構がうまく働かないため,細胞増殖が過剰になる。
上記EGFR調整不全は,がんで腫瘍が増殖する要因のひとつである。しかし,MLC患者において脳腫瘍の発生率が増加したという報告は今のところないため,他の要因が腫瘍形成につながる複雑なイベントに関与していることが論文中で示唆されている。また,MLC1同様にEGFR調節不全をもたらす常染色体優性多発性嚢胞腎(ADPKD)という疾患において,EGFRチロシンキナーゼ活性を阻害したところ症状が改善した例(Wilson S.J. et al., 2006)が示されている。
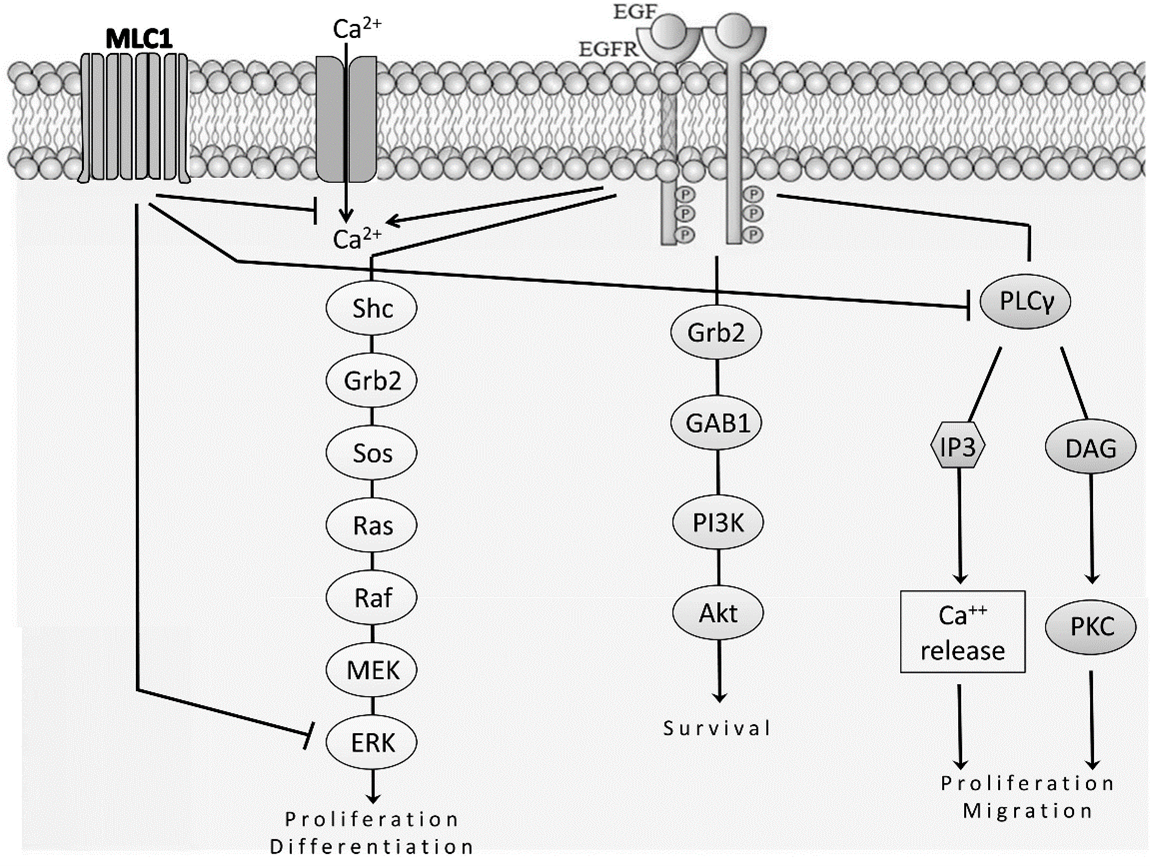
ヒトU251星状細胞腫細胞においてMLC1によって阻害されるEGFR活性化経路の概略図(論文より転載)
EGFRチロシンキナーゼ阻害薬などのがんの治療法がMLC1の治療に応用できるかもしれない。
チャネロパチーとしてのMLC(イタリアISS)
Brignone et al.(2015): MLC1 protein: a likely link between leukodystrophies and brain channelopathies; Front Cell Neurosci. 2015; 9: 66.; doi : 10.3389/fncel.2015.00106 [PMC]
イタリアISSの研究グループによるMLCのメカニズムに関する研究。MLC1変異の影響を,脳のチャネロパチー(イオンチャネルサブユニットまたはそれらを調節するタンパク質の機能の変化によって引き起こされる遺伝的または後天性の疾患)に関連付けられることが示されている(参考:チャネロパチー概論)。
MLC1と相互作用するタンパク質として,下図に示すタンパク質が挙げられている。
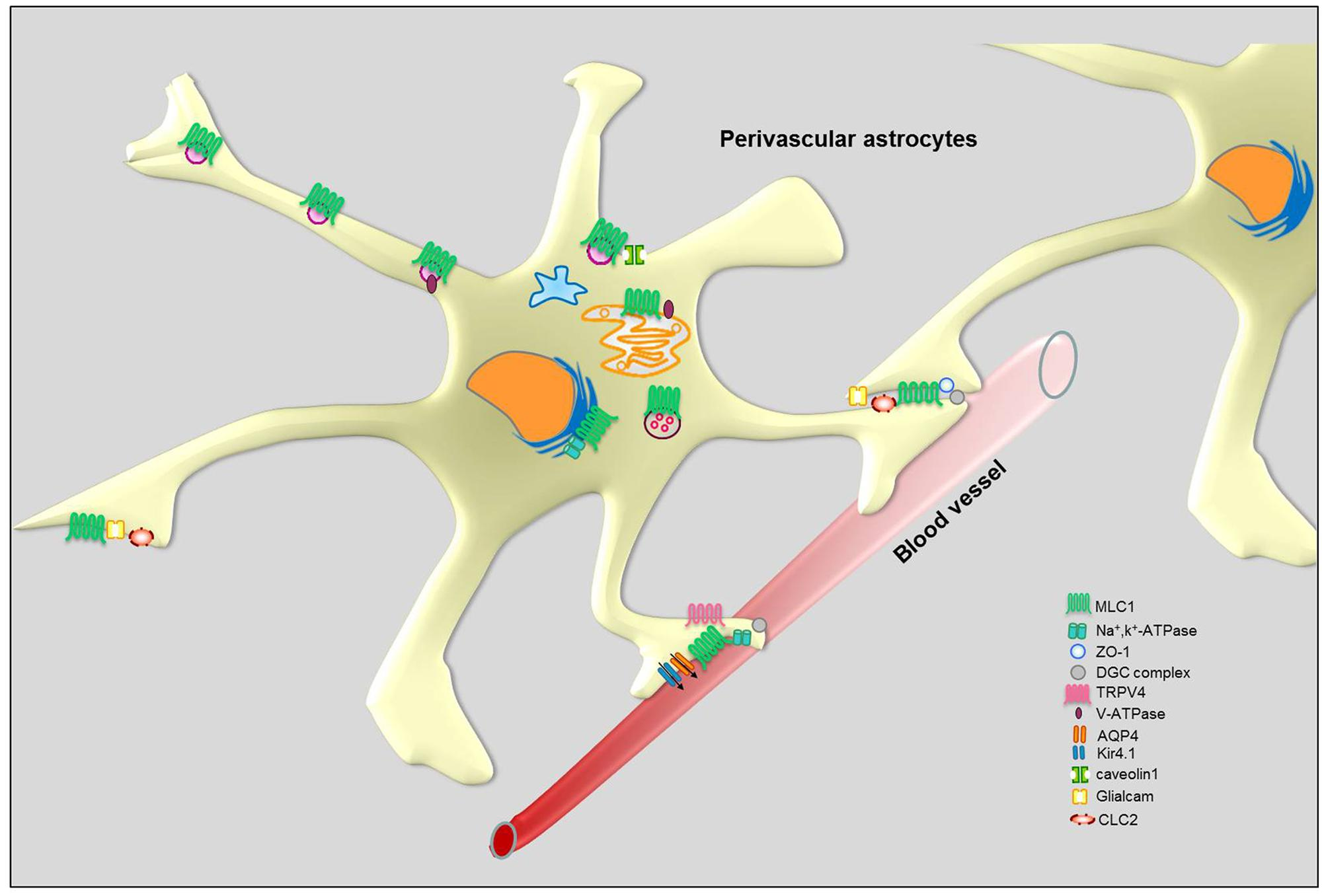
血管周囲星状細胞におけるMLC1分子相互作用の概略図(論文より転載)
ClC-2との相互作用について(バルセロナ大学)
Hoegg-Beiler et al.(2014): Disrupting MLC1 and GlialCAM and ClC-2 interactions in leukodystrophy entails glial chloride channel dysfunction; Nat Commun . 2014 Mar 19;5:3475. doi : 10.1038/ncomms4475
バルセロナ大学の研究グループによるMLCのメカニズムに関する研究。MLC1、GlialCAMと,ClC-2と呼ばれる塩素チャネルの役割や相互作用について調査している。MLC1,GlialCAMの変異により,ClC-2の局在や電流に変化をもたらし,白質ジストロフィーの症状を引き起こすことが示されている。ただし,MLC1,GlialCAMの変異がClC-2以外への影響があることも示唆している。
アストロサイト障害に起因する白質ジストロフィー(イタリアISS)
Lanciotti et al.(2013): Astrocytes: Emerging stars in leukodystrophy pathogenesis; Transl Neurosci. 2013 Jun 1; 4(2); doi : 10.2478/s13380-013-0118-1 [PMC]
イタリアISSの研究グループによる,アストロサイト障害に起因する白質ジストロフィーに関するレビュー論文。MLCがアストロサイトの障害に起因することが示されている。アストロサイトの障害による白質ジストロフィーとして,アレキサンダー病,白質消失病,MLCが同じカテゴリーとのこと。
アストロサイトに障害があると、さまざまな種類の病的傷害やストレス状態によって引き起こされる組織の恒常性の変化に対して脳がより脆弱になり、組織の損傷が悪化する可能性があるとして,頭部外傷や発熱のリスクを説明している。
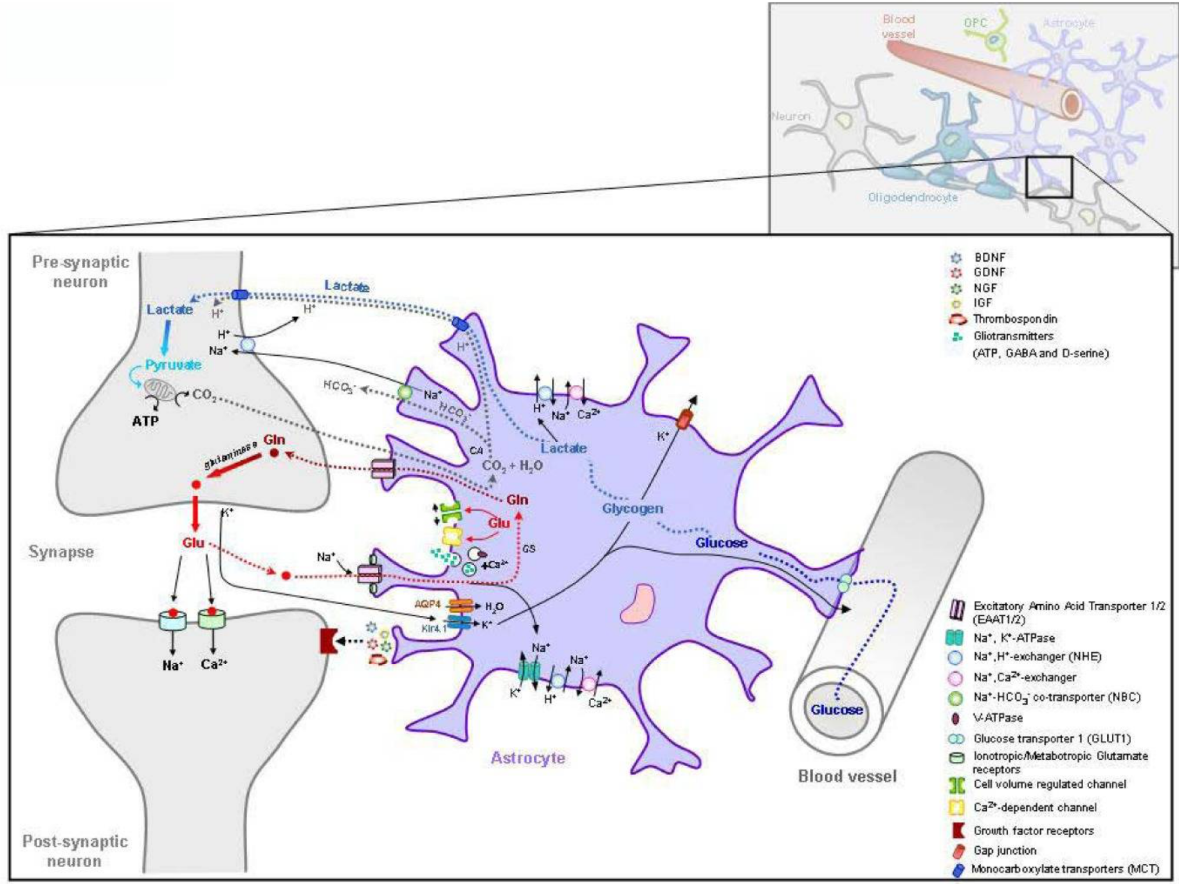
アストロサイトとニューロンの関係(論文より転載)
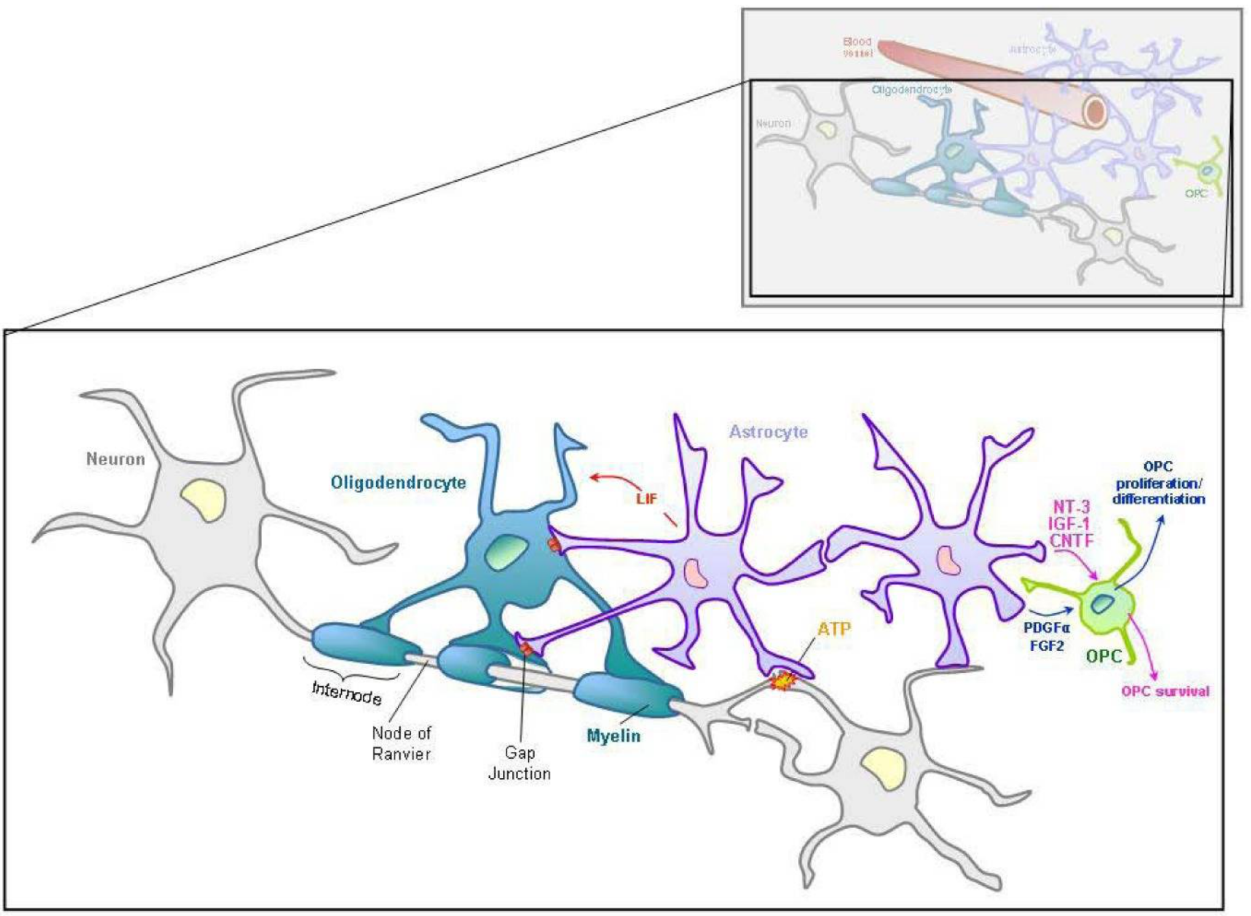
アストロサイトとオリゴデンドロサイトおよび
ミエリンとの関係(論文より転載)


