iPS細胞関連
白質ジストロフィーを対象にiPS細胞を活用した研究事例
Lanciotti et al.(2022): Human iPSC-Derived Astrocytes: A Powerful Tool to Study Primary Astrocyte Dysfunction in the Pathogenesis of Rare Leukodystrophies; Int. J. Mol. Sci. 2022, 23(1), 274; doi : 10.3390/ijms23010274
イタリアISSの研究グループによる報告。白質ジストロフィー,特にアストロサイト疾患について,これまで行われたiPS細胞を活用した研究事例が紹介されている。これまでアストロサイト疾患を対象としたiPSC研究は,MLCのほかに,アレキサンダー病(kondo et al.,2016,Li et al.,2018など),白質消失病(Leferink et al.,2019,Zhou et al.,2019),エカルディグディエール症候群(Thomas et al.,2017)などで行われており,そのほとんどが患者由来のiPSCからアストロサイトを分化誘導して分析したものであるが,Li et al.(2018)のみ,アストロサイトとオリゴデンドロサイトを共培養(Co-culture)して,その相互作用を調べている。
MLCのiPSC研究については,Lanciottiらが自ら研究を進めている内容が示されており,MLC患者iPSC由来のアストロサイトを対象とした分析から,これまで報告されていたEGFR / ERK経路の異常な活性化の他に,他の星状細胞障害(AxDおよびVWM)で同様に報告されている酸化的損傷、ミトコンドリア調節不全,小胞体ストレスなどの症状が新たに明らかにされたと示されている(原稿準備中とのこと)。
この他に,プラットフォームとしてのiPSC技術動向についても触れられている。これまで多く行われてきた単独の細胞を分化誘導する手法は2Dモデルと位置付けられ,複数細胞で構成される構造体を丸ごと再現できる最新技術として,3Dモデルと呼ばれる技術も開発されている。Madhavan et al.(2018)では,脳皮質の3Dモデル(皮質スフェロイド)を作成し,ペリツェウス-メルツバッハー病(PMD)の表現型の再現や,薬剤による治療効果の確認が行われたことが示されている。
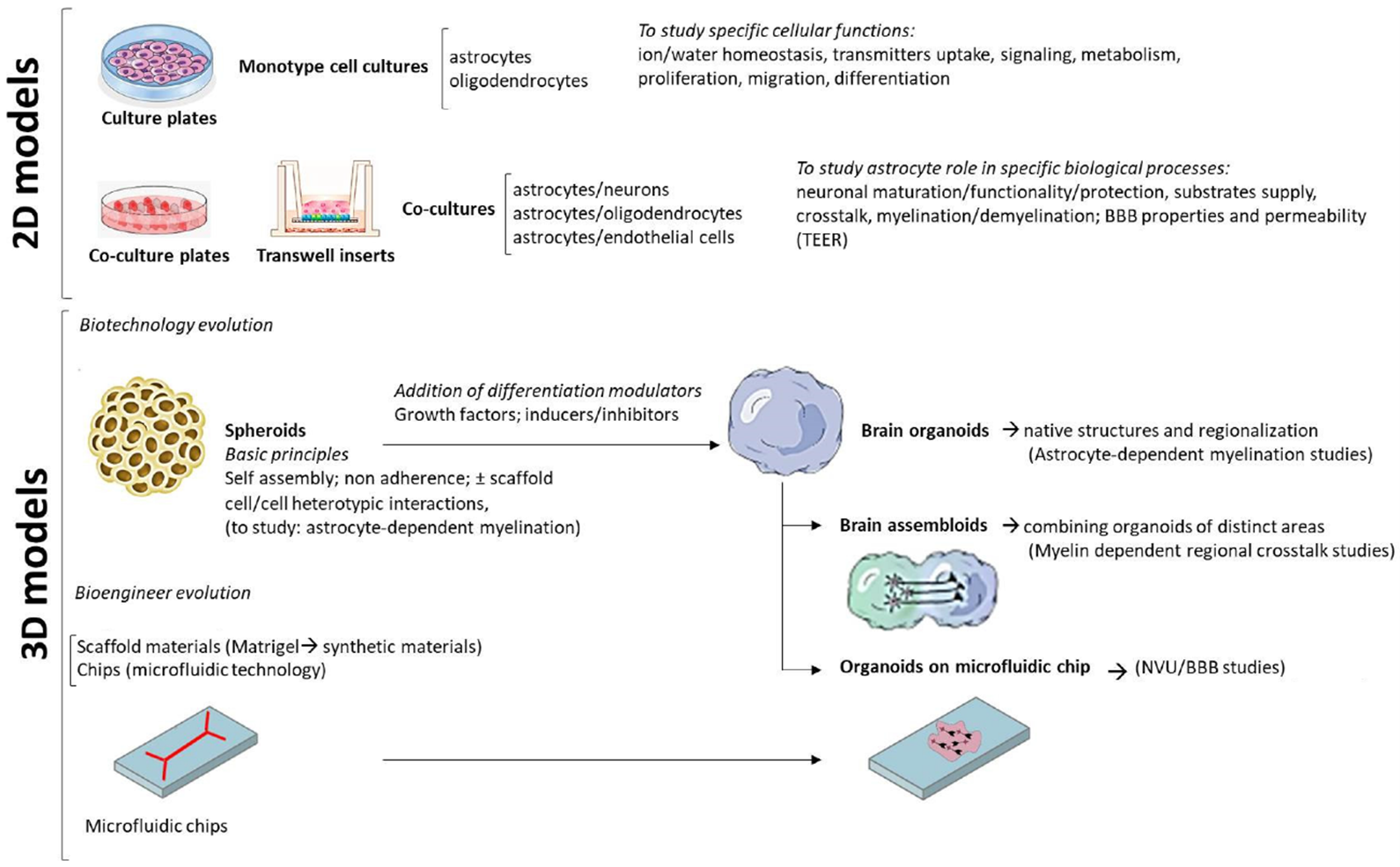
iPS細胞の2Dモデルと3Dモデル(論文より転載)
ISSのiPS細胞を用いたMLC研究により,病態解明がさらに進むことが期待できる。また,アレキサンダー病の事例(Li et al.,2018)に書いたアストロサイトとオリゴデンドロサイトを共培養する2Dモデルや,Madhavan et al.(2018)などに示される3Dモデルは,両細胞の相互作用を再現できるさらに高度なモデルとして今後の展開が期待できる。ただ,特に3Dモデルは最先端過ぎるので,1疾患の治療研究に用いられるにはもう少し時間がかかりそう。
白質消失病を対象としたiPSC研究
Zhou et al.(2019):Modeling vanishing white matter disease with patient-derived induced pluripotent stem cells reveals astrocytic dysfunction; CNS Neurosci Ther. 2019 Jun; 25(6): 759–771. (2019); doi : 10.1111/cns.13107 [PMC]
Deng et al.(2022): Secretomics Alterations and Astrocyte Dysfunction in Human iPSC of Leukoencephalopathy with Vanishing White Matter; Neurochem Res. 2022 Dec;47(12):3747-3760; doi : 10.1007/s11064-022-03765-z
北京大学の研究グループによる,VWMのiPS細胞を用いた病態解明に関する研究。いくつか論文が発表されており,2022年の論文ではVWM患者由来のiPS細胞をアストロサイトとオリゴデンドロサイト前駆細胞(OPC)に分化させ,eIF2B変異アストロサイトがOPCの分化や成熟に影響を与える分子を分泌することが示されている。
この研究グループは,MLCの症例報告や病態解明も行っていたグループ。
アレキサンダー病を対象としたiPSC研究
Li et al.(2018):GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in a human iPSC model of Alexander disease; Cell Stem Cell. 2018 Aug 2; 23(2): 239–251.e6.; doi: 10.1016/j.stem.2018.07.009 [PMC]
アメリカのベックマン研究所の研究グループによる報告。患者iPSC由来のアストロサイトと健康な人のiPSC由来のオリゴデンドロサイト前駆細胞(OPC)を共培養し,両者の相互作用を調べた研究。共培養したOPCが正常に増殖するか,成熟してオリゴデンドロサイトになるか,そのオリゴデンドロサイトがミエリンを作れるか,などを調べている。オリゴデンドロサイトがミエリンを生成できるかどうかの確認方法は,lee et al.(2012)などで示されている。
AxDに罹患したアストロサイトは,OPCの増殖を阻害し,有髄オリゴデンドロサイトを減少させる結果が得られて,これまでマウスでは再現できていなかった髄鞘形成の欠陥を再現できたことが示されている。
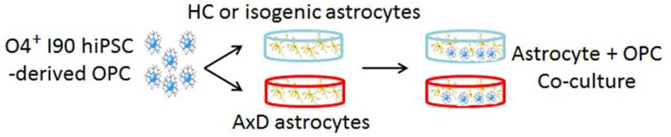
アストロサイトとオリゴデンドロサイトの共培養(論文より転載)
これまでの白質ジストロフィーに関するiPSCを用いた研究はいずれもアストロサイトあるいはオリゴデンドロサイトを単独で分化させるものだったが,この研究はアストロサイトとOPCを共培養した初めての研究(たぶん)。MLCでは,アストロサイトが原因となり,オリゴデンドロサイトの作成するミエリンの空胞化が症状として現れるため,この研究のように両者の相互作用を再現し,さらにミエリン空胞化まで再現できるモデルができれば,病態解明がさらに進むとともに,既存薬などの効果をより明瞭に判断できるツールとなる。
この論文で示された方法で確認できるのは,正常なミエリンを作れるかどうか,というところまでなので,仮に同様の方法をMLCに適用したとして,できたミエリンが空胞化するプロセスが再現できるかどうかは不明。
※lee et al.(2012):ナノファイバーで軸索を模擬して,ミエリンをナノファイバーに巻き付けさせることにより,ミエリン形成能力を定量的に測る手法が提案されている。
アレキサンダー病を対象としたiPSC研究
Kondo et al.(2016):Modeling Alexander disease with patient iPSCs reveals cellular and molecular pathology of astrocytes; Acta Neuropathologica Communications volume 4, Article number: 69 (2016); doi : 10.1186/s40478-016-0337-0 [PMC]
京大CiRA,自治医大,熊本大らの研究グループによる,同じアストロサイト疾患であるアレキサンダー病のiPS細胞を用いた病態解明に関する研究。これまでアストロサイトに関する病態研究は,疾患の原因となる遺伝子を強制的に過剰発現させた動物モデルなど頼ってきたが,iPS細胞の技術を用いて,実際の患者さんのアストロサイトを再現することで,病態メカニズムのさらなる解明や創薬開発への展開が期待できる。(参考:CiRAプレスリリース)
MLCに対しても,2021年8月現在イタリアのISSによるヒト由来iPS細胞を用いた研究が進行中らしい。日本でも同様の研究が動き出してくれれば嬉しい。
筋萎縮性側索硬化症(ALS)を対象としたiPSC研究
Imamura et al.(2017):The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis; Sci Transl Med . 2017 May 24;9(391):eaaf3962.; doi: 10.1126/scitranslmed.aaf3962
筋萎縮性側索硬化症(ALS)について,患者iPS細胞から分化した運動ニューロンを対象とした既存薬スクリーニングにより,Src/c-Ablという経路が影響を受けること,ボスチニブというSrc/c-Abl経路の活性化を阻害する薬剤が有効であるという知見が示されている。これを受けて,2019年に患者を対象とした臨床試験を開始したことが報告されている。
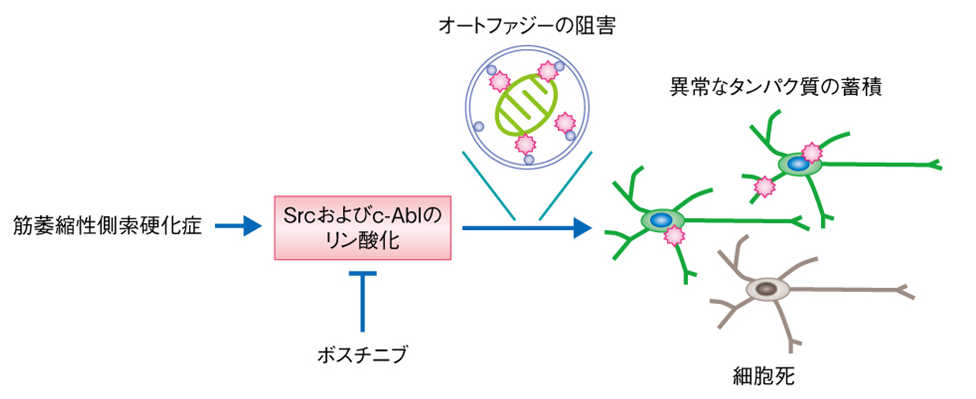
筋萎縮性側索硬化症の患者の運動ニューロンにおける病態(論文レビューサイトより)
ALSは全く違う病気ではあるが,遺伝子変異に起因するシグナル伝達経路の過剰活性が悪さしていると考えられている点,その阻害剤が有効である可能性がある点で共通しているので,何かしら参考になることがあるかもしれない。
ただ,ALSではニューロンの細胞死という明確な症状がiPSCで再現できているのに対し,MLCの症状として明瞭な指標となり得るミエリン空胞化はアストロサイトとオリゴデンドロサイトの相互作用まで再現する必要があり,既存薬スクリーニングにおいてはその点でより高いハードルがあると思われる。


